李晨曦,秦国政*
(云南中医药大学,云南 昆明 650500)
慢性前列腺炎(Chronic Prostatitis, CP)指各种病因引起前列腺组织的慢性炎症,是泌尿外科最常见疾病。CP主要发生在20 ~ 50岁的男性中,表现为会阴或下腹部长期反复疼痛不适[1]。据调查显示,大约35~50%的男性一生中受到前列腺炎的困扰[2]。性功能障碍和焦虑是其常见的并发症[3, 4],部分患者甚至出现不育症。CP患者伴随早泄和勃起功能障碍的发生率分别为45.3%和47.4% [5]。CP发病机制复杂,目前尚缺乏有效的治疗方案。药物治疗可暂时缓解部分症状,但长期效果不理想,症状易反复发作。CP的护理和治疗给患者带来了巨大的经济负担[6],且对男性的身心健康和生活质量造成极大的影响。因此,积极探索有效的措施防治CP成为当前的研究热点。
炎症、免疫反应异常、氧化应激损伤和内分泌失调都与CP的发生有密切的联系[7]。Lipopolysaccharide(LPS)是革兰氏阴性细菌细胞壁外壁的组成成分,常作用于上皮细胞膜表面的Toll-like receptor 4(TLR4)引起炎症反应[8]。TLR4是参与非特异性免疫的一类重要蛋白质分子,可通过 NF-κB 或 JNK/SAPK 途径启动细胞内的信号转导。TLR4 已被证明与启动炎症反应发生密切相关[9-11]。p38MAPK/NF-κB信号通路也是介导炎症产生的经典信号转导通路之一,p38MAPK是MAPK家族中的一个主要成员,是调控炎症反应的上游因子,NF-κB是参与调控细胞凋亡、增殖及炎症反应的下游基因[12]。MAPK、JNK、ERK等信号转导通路活化,会促使下游的NF-κB的磷酸化,介导炎症产生[13]。有研究表明,抑制 TLR4/NF-κB 和 TLR4/MAPK 通路可以治疗 LPS 诱导的炎症[14]。自噬失调与许多炎症性疾病发生密切相关,如肝病、心肌病、糖尿病等[15-17]。自噬能促进T细胞分化和恢复T细胞功能来治疗CP[18]。使用雷帕霉素增强自噬功能后,NLRP3介导的炎症反应明显减轻[19]。故增强细胞自噬可能促进CP缓解。
秦氏四妙散(QSSMS)是云南省名中医秦国政教授临床治疗CP的经验方,方剂由黄芪、玄参、金银花、甘草组成。依照中医外科学疮疡理论,灵活的将“消、托、补”三法应用于CP治疗的全过程,临床疗效显著[20, 21]。本研究采用秦氏四妙散治疗CP,通过体内和体外实验相结合探讨QSSMS是否通过增强自噬调控TLR4/p38MAPK/NF-κB信号通路治疗CP,揭示其科学内涵,为临床治疗CP提供理论依据。
1.材料和方法
1.1主要试剂和动物
大鼠IL-1β ELISA试剂盒(ml037361,酶联生物,中国);大鼠IL-6 ELISA试剂盒(ml102828,中国酶联生物);大鼠TNF-α ELISA试剂盒(ml002859,中国酶联生物);大鼠COX-2 ELISA试剂盒(ml058808,中国酶联生物);大鼠PGE2 ELISA试剂盒(ml003036,中国酶联生物);人IL-1β ELISA试剂盒(ml058059,中国酶联生物);人IL-6 ELISA试剂盒(ml058097,中国酶联生物);人TNF-α ELISA试剂盒(ml077385,中国酶联生物);人COX-2 ELISA试剂盒(ml062904,中国酶联生物);人PGE2 ELISA试剂盒(ml024761,中国酶联生物);Mouse Anti-NFKB p65 antibody(1:1000稀释,bsm-33117M,中国博奥森);Rabbit Anti-P38 MAPK antibody(1:1000稀释,bs-0637R,中国博奥森);Rabbit Anti-phospho-NFKB p65 (Thr435) antibody (1:1500稀释,bs-5661R,中国博奥森) ;Rabbit Anti-Phospho-P38 MAPK (Thr180 + Tyr182) antibody (1:1500稀释,bs-0636R,中国博奥森) ;角叉菜胶(C1013-25G,美国西格玛);Anti-TLR4 antibody (1:2000稀释,bs-20594R,中国博奥森) ;Anisomycin(176880,美国西格玛);LPS( L118716,中国阿拉丁); Anti-Beclin 1 antibody (1:1000,ab62557,英国Abcam) ;抗p62/SQSTM1 兔抗(P0067,美国西格玛);抗-LC3B 兔抗(1:1500,L7543,美国西格玛);角叉菜胶(C1013-25G,Merck,USA);酶标仪(SPECTCA MAX190,Molecular,美国);快速混匀器(MX-S,SCILOGEX,美国);正置荧光显微镜(NIKON ECLIPSE C1,日本尼康)。
50只成年雄性Wistar大鼠(250~300克;6~8周龄)由成都达硕实验动物有限公司提供。许可证号:SCXK(川)2020-030。所有大鼠均在20~25℃饲养和50%-65%相对湿度。由云南中医药大学实验动物福利与伦理委员会批准(批准号:R-06202075)。根据美国国立卫生研究院的实验室动物护理和使用指南。批准日期:2020年11月3日。
1.2细胞培养
人前列腺上皮细胞(CP-H019)在含有10%胎牛血清和1%青霉素链霉素的DMEM培养基中生长,并在含有5% CO2的环境中保持37℃。采用0.02 μg/mL LP诱导构建细胞炎症模型,用CCK8测定QSSMS有效安全浓度。QSSMS低、中、高浓度(5μg/ml、10μg/ml、20μg/ml)分别干预LPS炎症模型,检测结果。最后,加入P38 MAPK信号转导通路激活剂Anisomycin,做进一步机制探讨。
1.3秦氏四妙散及治疗给药
由黄芪(30g)、金银花(10g)、玄参(30g)、甘草(10g)组成(均购自云南省中医医院,中国云南),每剂总量为80克。取适量中药饮片,将其在常冷水中浸泡20min,煎煮25分钟后,换水重复3次,将3次的水煎液合并后再浓缩,经过多次过滤、浓缩、蒸馏,制成中药浸膏。制备后,在4℃冰箱保存。按照人鼠体表面积法,将人体日治疗剂量(80g)作为中剂量,计算出QSSMS-L(秦氏四妙散低剂量组)、QSSMS-M (秦氏四妙散中剂量组)、QSSMS-H(秦氏四妙散高剂量组)大鼠灌胃剂量分别为4g/kg/d,8g/kg/d、16g/kg/d。将其悬浮在0.9%的盐水中进行胃内给药。
1.4UHPLC-MS/MS设置条件
使用Thermo Ultimate 3000 RS系统,色谱柱Welch UHPLC Ultimate XB-C18(50 2.1 mm, 1.8 μm),耦合超高分辨率的质量分析器 Orbitrap (Thermo Q Exacutive) 进行 LC-MS/MS 分析。流动相由 0.1 % 甲酸水溶液和甲醇组成,流速 0.3 mL/min,进样体积 5 μL,柱温 35 ℃, 洗脱梯度如下:0~1 min,2 % B;5 min,20 % B;10 min,50 % B; 15 min,80 % B;20~25 min,95 % B;26~30 min,2 % B,采集软件 Xcalibur 4.0 (Thermo Fisher)。质谱在正负离子切换下 Fullmass/dd-MS2 模式检测,分辨率分别为 70000/17500,扫描质荷比在 150~2000 范围 的离子,选择 200 ms 内响应大于 3e6 的离子进行二级碎裂(进入质量分析器的离子最大累积时间为 50 ms),ESI 源设置条件为:鞘气 40 Arb,辅助气 15 Arb,电喷雾电压 3.8 kV,离子源温度 350 ℃。
1.5动物模型和治疗
50只大鼠分为5组(每组10只):对照组、模型组、QSSMS低剂量组、QSSMS中剂量组、QSSMS高剂量组。对照组为假手术组。根据Dai YH等人的方法建立CP大鼠模型[22, 23]。用乙醚将大鼠麻醉后,剪开腹部皮肤1~1.5cm,找到前列腺,除对照组外,其它组大鼠前列腺腹侧叶分别用1ml的注射器注射1% Carrageenan 100ul,Control group大鼠相同部位注入0.9%氯化钠溶液100ul,缝合皮肤后正常饲养,7天后用秦氏四妙散高、中、低剂量分别进行灌胃,模型组和Control group用等量生理盐水灌胃,每天固定时间喂养一次。灌胃至第35天后,用乙醚麻醉后,迅速取出前列腺组织,脱颈处死大鼠,将待测样本剪切分装待检测,剩余样本储存于-80℃冰箱。
1.6 HE染色
取适量新鲜大鼠前列腺组织,浸泡于4%多聚甲醛固定液中,然后制作石蜡切片。常规脱蜡、水化。蒸馏水洗涤(5min)。苏木素染色(8min)。自来水洗去浮色,1%盐酸酒精分化(2s)。伊红室温染色(3s)。自来水终止显色。梯度酒精脱水 (75%, 80%, 85%, 90%, 100%, 100%),各10min。二甲苯透明(30min)。中性树胶封片,全息扫描。
1.7 ELISA测定
用匀浆器将前列腺组织充分打碎,离心,取上清液。将40μl样品稀释剂与10μl样品在96孔板中混匀。向每个孔中添加100μl酶标试剂。37℃下孵育(60分钟),洗涤5次。向每个孔中依次添加显色剂A和B(各50μl),37℃避光显色(15 min)。依次每孔加终止液50ul。空白孔调零,15分钟内用酶标仪在450nm波长依序测量各孔的光密度(OD值)。
1.8 Quantitative Real-time PCR
使用Trizol试剂(Invitrogen,Carlsbad,CA)从大鼠前列腺组织中提取总RNA。使用反转录试剂盒合成cDNA。实时PCR分析在ABI 7500实时PCR系统上进行,使用SYBRTM预混料Ex-TagTM。所使用的引物序列如表1所示。
表1 Primer Information.

1.9 Western blotting
取适量大鼠前列腺组织,充分匀浆,在裂解缓冲液中裂解30分钟,离心后收集上清液。蛋白浓度用BCA试剂盒测定。将蛋白质变性,进行SDS-PAGE,转膜,封闭,加入一抗,将膜放在4℃摇床过夜。第二天,清洗,加入二抗培养1-2小时。将增强的荧光液滴到膜上,检测蛋白表达。所有图像均由GeneGnome XRQ化学发光成像系统拍摄。用ImageLab软件(版本3.0,BioRad,美国)分析斑点的灰度值。β-肌动蛋白作为内部对照。
1.10免疫荧光
将载玻片置于PBS(pH 7.4)中,浸洗3次,每次3min。4%的多聚甲醛固定(30min)。PBS漂洗3次,每次5min。0.2% Triton X-100室温通透(20min)。PBS漂洗3次,每次5min。封闭(60min)。加入一抗4℃冰箱过夜。第二天,清洗后,加二抗孵育2h,PBS漂洗4次,每次5min。封片,荧光显微镜下观察拍照。
1.11统计分析
用GraphPad Prism 8.0软件(美国加利福尼亚州圣地亚哥GraphPad)进行统计分析。结果以平均值±标准差(SD)表示。两组之间比较采用独立样本t检验,三组以上的实验数据采用单因素方差分析,组间比较采用L.S.D 法。P<0.05 被认为差异具有统计学意义。其中*代表P<0.05,**代表P<0.01。
2.结果
2.1用UHPLC-MS筛选QSSMS的活性成分
QSSMS是由黄芪、玄参、金钱草和甘草组成。基于 Q-Orbitrap 高分辨液质联用的植物药膏中化学成分鉴定研究报告显示,中药甲醇提取物样本在 mzCloud 中共匹配到 1178 个化合物。mzCloud best match 中 183 个化合物综合评分大于 80分,匹配度较高的包括18-β-甘草次酸、异甘草素、芒柄花素、麦芽酚、大豆苷元、葫芦巴碱、皂甙、齐墩果酸、芒柄花甙等(表2)。QSSMS的主要活性成分可能是其中的一种或多种。QSSMS中天然产物鉴定总离子流图谱(图1)。

图1 (A)黑色是负离子模式下的总离子电流;(B)红色为正离子模式下的总离子电流
表 2 Components of QSSMS were analyzed by UHPLC-MS/MS analysis.

2.2 QSSMS修复前列腺组织损伤,抑制炎症相关因子表达
角叉菜胶诱导的CP模型广泛应用于动物科研实验,可操作性强,易被人们接受。且在大鼠前列腺组织中表现出剧烈的炎症反应,稳定性强。第8至35天给CP大鼠灌胃QSSMS 低、中、高剂量(4g/kg/d,8g/kg/d、16g/kg/d)后,HE染色观察前列腺组织形态结构变化。与对照组相比,模型组大鼠前列腺组织中出现明显的淋巴细胞浸润,腺泡直径减小,腺腔扩张,间质水肿,证实了模型复制成功。服用QSSMS后,前列腺组织腺腔结构基本完整,间质间隙减小,腺腔及间隙炎性细胞浸润减少,纤维细胞增生和血管增生减轻。(图2A)。同时,模型组大鼠前列腺组织中炎症相关因子IL-6、IL-1β、TNF-α、COX-2、PGE2表达较对照组明显升高(P<0.05)。使用QSSMS灌胃治疗后炎症相关因子IL-6、IL-1β、TNF-α、COX-2、PGE2表达水平降低(p<0.05),且呈剂量依赖性,高剂量效果最好(图2B)。总之,这些发现说明了QSSMS在大鼠前列腺组织中缓解作用。

图2 前列腺组织病理HE染色及细胞因子表达
注:(A)大鼠前列腺组织HE染色 (放大倍数200×)。(B)大鼠前列腺组织中细胞因子IL-1β、IL-6、TNF-α、COX-2和PGE2的表达水平。所示数据为六个独立实验的数据用平均值±SEM表示。(NS无显著性,*P < 0.05,**P < 0.01)。
2.3 QSSNS抑制大鼠前列腺组织中TLR4/p38MAPK/NF-κB信号通路表达
TLR4/NF-κB 和 TLR4/MAPK信号通路在介导炎症发生过程中起着重要作用。与对照组相比,模型组大鼠TLR4、p-p38和p-p65的蛋白质表达水平升高(P<0.05)。使用QSSMS治疗后,TLR4、p-p38和p-p65的蛋白质表达水平降低(P<0.05)(图3A)。说明QSSNS抑制大鼠前列腺组织中TLR4/p38MAPK/NF-κB信号通路表达。
2.4 QSSMS在大鼠前列腺组织中激活自噬
自噬是一种清道夫机制,在抵抗病原体和清除细胞碎片方面起着重要作用。有研究表明,CP与前列腺组织中自噬不足有关。我们观察到模型组大鼠LC3B-II和Beclin1的蛋白质表达较对照组明显减少(P<0.05),SQSTM1(p62)蛋白明显增多(P<0.05),自噬相关基因ATG5、ATG7、ATG16L和Beclin1的mRNA表达水平降低(P<0.05)。使用QSSMS治疗后,LC3B-II和Beclin1的蛋白质表达水平较高(P<0.05),LC3-II/LC3-I的比率较高(P<0.05),但SQSTM1(p62)蛋白水平低于模型动物(P<0.05)。自噬相关基因ATG5、ATG7、ATG16L和Beclin1的mRNA表达水平显著升高(P<0.05)(图3B和3C)。

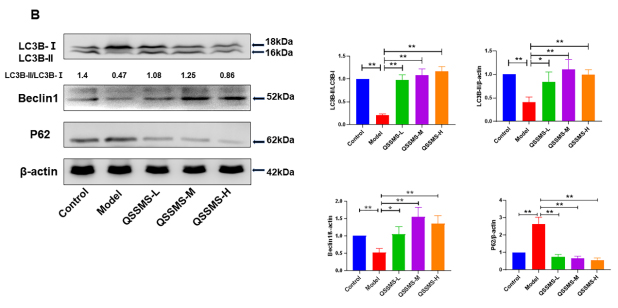

图3 大鼠前列腺组织中蛋白及mRNA的表达水平
注:(A) Western blotting检测大鼠前列腺组织中TLR4/p38MAPK/NF-κB信号通路相关蛋白的表达水平。(B) Western blotting检测大鼠前列腺组织中自噬相关蛋白LC3B-II、Beclin1和P62的表达水平。(C) ATG5、ATG7、ATG16L、Beclin1 mRNA在大鼠前列腺组织中的相对表达水平。所示数据为六个独立实验的数据用平均值±SEM表示。(NS无显著性,*P < 0.05,**P < 0.01)。
2.5 QSSMS抑制人前列腺上皮细胞中炎症表达
在人前列腺上皮细胞炎症模型中,我们同样观察到模型组前列腺上皮细胞中炎症相关因子IL-6、IL-1β、TNF-α、COX-2、PGE2表达较对照组明显升高(P<0.05)。加入QSSMS治疗后,炎症相关因子IL-6、IL-1β、TNF-α、COX-2、PGE2表达水平降低(p<0.05),且呈剂量依赖性,高剂量效果最好(图4)。说明了QSSMS缓解了人前列腺上皮细胞中炎症反应。

图4 人前列腺上皮细胞中炎症相关因子表达
注:(A)人前列腺上皮细胞中IL-1β、IL-6、TNF-α、COX-2、PGE2的表达水平。所示数据为六个独立实验的数据用平均值±SEM表示。(ns无显著性,*P < 0.05,**P < 0.01)。
2.6 QSSMS抑制人前列腺上皮细胞中TLR4/p38MAPK/NF-κB信号通路表达
在细胞实验中,我们观察加入LPS后,人前列腺上皮细胞中p-p38和p-p65的蛋白质表达水平显著升高(P<0.05)。使用QSSMS治疗后,TLR4、p-p38和p-p65的蛋白质表达水平降低(P<0.05)(图5A)。分析免疫荧光照片,我们同样发现模型组前列腺上皮细胞中p-p38和p-p65蛋白荧光强度明显高于对照组。使用QSSMS治疗后,p-p38和p-p65的蛋白荧光强度明显降低(图5B和5C)。说明QSSMS抑制人前列腺上皮细胞中TLR4/p38MAPK/NF-κB信号通路表达。
2.7 QSSMS在人前列腺上皮细胞中激活自噬
自噬过程伴随着LC3B-I向LC3B-II的转化。我们观察加入LPS后,LC3B-II和Beclin1蛋白质表达水平降低(P<0.05),p62的底物水平显著升高(P<0.05)。自噬相关基因ATG5、ATG7、ATG16L和Beclin1的mRNA表达水平显著下降(P<0.05)。加入不同浓度的QSSMS后,LC3B-II和Beclin1蛋白质表达水平升高(P<0.05),p62的底物水平显著降低(P<0.05)。此外,我们还发现自噬相关基因ATG5、ATG7、ATG16L和Beclin1的mRNA表达水平显著升高(P<0.05)(图5D和5E)。故这些发现表明QSSMS在人前列腺上皮细胞中激活自噬。





图5 人前列腺上皮细胞中蛋白及基因mRNA表达水平
注:(A) Western blotting检测人前列腺上皮细胞中TLR4/p38MAPK/NF-κB信号通路相关蛋白的表达水平。(B)磷酸化绿色荧光蛋白P38 (GFP-p-p38)在前列腺上皮细胞中的表达,DAPI染色细胞核(放大倍数200×)。(C)人前列腺上皮细胞GFP-p-p65的表达,DAPI染色细胞核(放大倍数200×)。(D) Western blotting检测人前列腺上皮细胞自噬相关蛋白LC3B-II、Beclin1和P62的表达水平。(E) ATG5、ATG7、ATG16L、Beclin1 mRNA在人前列腺上皮细胞中的相对表达水平。所示数据为六个独立实验的数据用平均值±SEM表示。(NS无显著性,*P < 0.05,**P < 0.01)。
2.8加入通路激活剂后,人前列腺上皮细胞中炎症水平上升
Anisomycin是p38MAPK信号转导通路激活剂,能诱导炎症反应的发生。为进一步明确QSSMS是否通过抑制p38MAPK/NF-κB信号通路治疗CP。我们发现加入Anisomycin后,TLR4、p-p38和p-p65的蛋白质表达水平较对照组明显升高(P<0.05)(图6A)。观察免疫荧光照片,我们同样发现Anisomycin组p-p38和p-p65蛋白荧光强度明显强于对照组(图6B和6C)。此外,Anisomycin组炎症相关因子IL-6、IL-1β、TNF-α、COX-2、PGE2表达较对照组显著升高(p<0.05),与模型组几乎无明显差异(图6D)。
2.9加入激活剂后,人前列腺上皮细胞中自噬水平下降
为进一步明确QSSMS是否通过增强自噬抑制炎症来缓解CP。我们发现加入Anisomycin后,LC3B-II和Beclin1蛋白质表达水平较对照组明显降低(P<0.05),p62的底物水平显著升高(P<0.05)(图6E)。此外,自噬相关基因ATG5、ATG7、ATG16L和Beclin1的mRNA表达水平较对照组显著降低(P<0.05)(图6F)。





图6 人前列腺上皮细胞中蛋白和mRNA的表达
注:(A)加入Anisomycin后,Western blotting检测人前列腺上皮细胞TLR4/p38MAPK/NF-κB信号通路相关蛋白的表达水平。(B)人前列腺上皮细胞GFP-p-p38的表达,DAPI-stained细胞核(放大倍数200×)。(C)人前列腺上皮细胞GFP-p-p65的表达,DAPI-stained细胞核(放大倍数200×)。(D)大鼠前列腺上皮细胞中IL-1β、IL-6、TNF-α、COX-2、PGE2的表达水平。(E)加入Anisomycin后,用western blotting检测人前列腺上皮细胞自噬相关蛋白LC3-II、Beclin1和P62的表达水平。(F)加入Anisomycin后ATG5、ATG7、ATG16L、Beclin1 mRNA在人前列腺上皮细胞中的相对表达量。所示数据为六个独立实验的平均值±SEM。(NS无显著性,*P < 0.05,**P < 0.01)。
3.讨论
CP发病因素和作用机制复杂,临床治疗显得十分困难。为了更好地研究CP,我们采用角叉菜胶前列腺内注射法成功复制大鼠CP模型,此法造模较自身免疫性法、去势加激素诱导法、其它化学注射法具有成功率高,重复性好,引起前列腺组织损伤较小,更类似于慢性炎症等优势[24, 25]。在注射角叉菜胶7天后,我们发现了与Dong D和Zhang C实验相似的一幕,模型组大鼠前列腺组织病理学发现大量的中性粒细胞、淋巴细胞浸润,间质内纤维组织明显增生,腺泡甚至腺上皮部分脱落等现象,说明大鼠CP模型成功复制[26, 27]。然而,在给予QSSMS治疗28天后,前列腺组织中炎性细胞浸润明显减轻,间质内纤维组织增生缓解,腺泡水肿减少,且呈剂量依赖性,高剂量组效果最佳。
有研究显示,促炎介质TNF-α、白细胞介素-1β(IL-1β)、IL-6、IL-8的表达增多和NF-κB信号通路的活化是引起CP的主要原因之一,通过抗炎、抗氧化应激、抗纤维化有利于CP缓解[28]。COX-2升高也是CP的关键特征之一,它会诱导PGE2合成增加,加重CP大鼠的炎症反应。通过负调节COX-2表达来抑制前列腺上皮细胞增殖,有助于缓解慢性非细菌性前列腺炎[29]。在我们的实验中,发现模型组大鼠前列腺组织中及人前列腺上皮细胞中炎症相关因子IL-6、IL-1β、TNF-α、COX-2、PGE2表达水平较对照组明显升高。采用QSSMS干预后,大鼠前列腺组织中及人前列腺上皮细胞中IL-6、IL-1β、TNF-α、COX-2、PGE2表达水平明显降低,与Peng X和Xu X研究结果基本一致。槲皮素可改善前列腺组织的病理损伤,降低促炎细胞因子 IL-1β、IL-6、IL-17A和 TNF-α 表达,提高了机体抗氧化水平,可能是基于抑制 MAPK和NF-κB 信号转导通路活化来实现的[30]。抑制 TLR4/NF-κB 和激活 Nrf2/HO-1 信号通路有助于小鼠子宫内膜炎的缓解[31]。运用药物抑制TLR4/NF-κB信号通路,有助于改善神经炎症相关的记忆障碍和神经变性[32]。在我们的实验中,运用WB检测发现CP大鼠模型组前列腺组织及人前列腺上皮细胞中TLR4、p-p38MAPK、p-p65蛋白表达较对照组明显升高。服用QSSMS治疗后,大鼠前列腺组织及人前列腺上皮细胞中TLR4、p-p38MAPK、p-p65蛋白表达较模型组明显降低。免疫荧光检测中同样发现了这种现象,说明QSSMS可能通过抑制该通路发挥治疗作用,与Meng L Q、Xu M和Zhang F 的研究结果相似。
自噬是发生于细胞中的一种生物学过程,基于此实现细胞本身的代谢需要和某些细胞器的更新。报道显示,通过自噬机制可以清除细胞内的炎症小体或炎症因子。丹参中衍生物通过介导细胞自噬减轻了血管平滑肌细胞的炎症[33]。自噬通过调控mTOR、AMPK、NF-κ B信号转导通路,抑制炎性小体的激活及炎症因子表达,有利于急性肾损伤的恢复[34]。神经炎症会激活神经保护性自噬机制,调控自噬基因可能是治疗神经退行性炎症疾病的主要方案之一 [35]。在我们的实验中,发现CP大鼠模型组前列腺组织及人前列腺上皮细胞中自噬蛋白LC3B-II和Beclin1蛋白质表达水平降低,p62的底物水平显著升高。自噬相关基因ATG5、ATG7、ATG16L和Beclin1的mRNA表达水平显著下降。服用QSSMS治疗后,LC3B-II和Beclin1蛋白质表达水平升高,p62的底物水平显著降低。自噬相关基因ATG5、ATG7、ATG16L和Beclin1的mRNA表达水平显著升高。由此可见,QSSMS在大鼠前列腺组织及人前列腺上皮细胞中增强了自噬。
p38MAPK信号通路活化可能是引起银屑病皮炎的主要原因[36]。Anisomycin是JNK和p38MAPK信号通路的活化剂[37]。 Anisomycin可以逆转药物对小鼠炎症因子下调和氧化应激的保护作用[38]。为进一步明确QSSMS是否通过增强自噬抑制TLR4/p38MAPK/NF-κB信号通路治疗CP。我们在细胞实验中加入Anisomycin,发现TLR4、p-p38和p-p65的蛋白质表达水平较对照组明显升高,免疫荧光检测也同样证实了这种现象。炎症相关因子IL-6、IL-1β、TNF-α、COX-2、PGE2表达较对照组显著升高。说明Anisomycin激活了p38MAPK信号通路,诱导了炎症反应。这与Sakurai K和Li J的研究结果一致。此外,加入Anisomycin后,LC3B-II和Beclin1蛋白质表达水平较对照组明显降低,p62的底物水平显著升高。自噬相关基因ATG5、ATG7、ATG16L和Beclin1的mRNA表达水平较对照组显著降低。说明Anisomycinp激活了p38MAPK/NF-κB信号通路,抑制了细胞自噬,进而介导了炎症反应。我们用反证法证明了QSSMS可能通过增强自噬抑制TLR4/p38MAPK/NF-κB信号通路治疗CP(如图7)。有研究显示,TLR4-MyD88-MAPK和NF-κB信号转导通路可以调控mTOR依赖性自噬通量,抑制自噬会加重LPS诱导的炎症和氧化损伤[39]。黄芪甲苷通过抑制 TLR4/NF-κB 信号通路诱导自噬,有助于缓解炎症[40]。我们的研究结论与Zhou M和Ying Y的发现基本一致。

图7 QSSMS可能通过抑制TLR4/p38MAPK/NF-κB信号通路增强自噬,抑制炎症因子的表达
4.结论
综上所述,QSSMS的活性成分可能通过抑制TLR4/p38MAPK/NF-κB信号通路,增强自噬水平,降低炎症因子的表达,进而缓解CP。本研究揭示了QSSMS缓解CP的科学内涵,为中医药防治CP提供了新的思路和策略。
参考文献
[1] Nickel J C, Shoskes D A, Wagenlehner F M. Management of chronic prostatitis/chronic pelvic pain syndrome (CP/CPPS): the studies, the evidence, and the impact. World J Urol,2013,31(4):747-753.
[2] Rees J, Abrahams M, Doble A, et al. Diagnosis and treatment of chronic bacterial prostatitis and chronic prostatitis/chronic pelvic pain syndrome: a consensus guideline. BJU Int,2015,116(4):509-525.
[3] Mehik A, Hellstrom P, Sarpola A, et al. Fears, sexual disturbances and personality features in men with prostatitis: a population-based cross-sectional study in Finland. BJU Int,2001,88(1):35-38.
[4] Ku J H, Kim S W, Paick J S. Quality of life and psychological factors in chronic prostatitis/chronic pelvic pain syndrome. Urology,2005,66(4):693-701.
[5] Zhang Y, Zheng T, Tu X, et al. Erectile Dysfunction in Chronic Prostatitis/Chronic Pelvic Pain Syndrome: Outcomes from a Multi-Center Study and Risk Factor Analysis in a Single Center. PLoS One,2016,11(4):e153054.
[6] Schaeffer A J. Epidemiology and evaluation of chronic pelvic pain syndrome in men. Int J Antimicrob Agents,2008,31 Suppl 1:S108-S111.
[7] Pontari M A. Etiology of chronic prostatitis/chronic pelvic pain syndrome: psychoimmunoneurendocrine dysfunction (PINE syndrome) or just a really bad infection? World J Urol,2013,31(4):725-732.
[8] Sun X, Luo S, Jiang C, et al. Sodium butyrate reduces bovine mammary epithelial cell inflammatory responses induced by exogenous lipopolysaccharide, by inactivating NF-kappaB signaling. J Dairy Sci,2020,103(9):8388-8397.
[9] Fang H, Wang P F, Zhou Y, et al. Toll-like receptor 4 signaling in intracerebral hemorrhage-induced inflammation and injury. J Neuroinflammation,2013,10:27.
[10] Hyakkoku K, Hamanaka J, Tsuruma K, et al. Toll-like receptor 4 (TLR4), but not TLR3 or TLR9, knock-out mice have neuroprotective effects against focal cerebral ischemia. Neuroscience,2010,171(1):258-267.
[11] Ahmad A, Crupi R, Campolo M, et al. Absence of TLR4 reduces neurovascular unit and secondary inflammatory process after traumatic brain injury in mice. PLoS One,2013,8(3):e57208.
[12] Perkins N D. Integrating cell-signalling pathways with NF-kappaB and IKK function. Nat Rev Mol Cell Biol,2007,8(1):49-62.
[13] Feng D, Ling W H, Duan R D. Lycopene suppresses LPS-induced NO and IL-6 production by inhibiting the activation of ERK, p38MAPK, and NF-kappaB in macrophages. Inflamm Res,2010,59(2):115-121.
[14] Liu C, Tang X, Zhang W, et al. 6-Bromoindirubin-3'-Oxime Suppresses LPS-Induced Inflammation via Inhibition of the TLR4/NF-kappaB and TLR4/MAPK Signaling Pathways. Inflammation,2019,42(6):2192-2204.
[15] Codogno P, Meijer A J. Autophagy in the liver. J Hepatol,2013,59(2):389-391.
[16] Zaglia T, Milan G, Ruhs A, et al. Atrogin-1 deficiency promotes cardiomyopathy and premature death via impaired autophagy. J Clin Invest,2014,124(6):2410-2424.
[17] Osorio J. Diabetes: Protective role of autophagy in pancreatic beta cells. Nat Rev Endocrinol,2014,10(10):575.
[18] Liu Y, Zhang Y, Zhang M, et al. Activated autophagy restored the impaired frequency and function of regulatory T cells in chronic prostatitis. Prostate,2021,81(1):29-40.
[19] Lu J, Su Y, Chen X, et al. Rapamycininduced autophagy attenuates hormoneimbalanceinduced chronic nonbacterial prostatitis in rats via the inhibition of NLRP3 inflammasomemediated inflammation. Mol Med Rep,2019,19(1):221-230.
[20] 秦国政,张春和,李焱风,等. 基于疮疡理论论治慢性前列腺炎专家共识. 中医杂志,2017,58(05):447-450.
[21] 秦国政,李焱风,杨毅坚,等. 从疮疡论治慢性前列腺炎的多中心临床观察. 中华中医药杂志,2018,33(09):4209-4212.
[22] 王那钦,宫傲磊,严倩琳,等. 益气通络排浊颗粒对慢性非细菌性前列腺炎大鼠TXB_(2)、6-K-PGF_(1α)的影响. 辽宁中医杂志,2021:1-6.
[23] 戴应和,龙小琴,刘晨琪,等. 角叉菜胶诱导慢性非细菌性前列腺炎动物模型的制备与评价. 中国实验动物学报,2017,25(05):544-550.
[24] Zeng F, Chen H, Yang J, et al. Development and validation of an animal model of prostate inflammation-induced chronic pelvic pain: evaluating from inflammation of the prostate to pain behavioral modifications. PLoS One,2014,9(5):e96824.
[25] Radhakrishnan R, Nallu R S. Development and characterisation of a novel animal model of prostate inflammation-induced chronic pelvic pain. Inflammopharmacology,2009,17(1):23-28.
[26] 董德刚,宋梅,易军,等. 慢性非细菌性前列腺炎大鼠前列腺线粒体损伤及解毒活血汤干预作用研究. 中华男科学杂志,2021,27(06):483-488.
[27] 张春玲,范顺明,李星,等. 知母黄柏盐制前后组成滋肾丸对慢性前列腺炎及肠道菌群的对比研究. 中药药理与临床,2021,37(01):34-40.
[28] Peng X, Guo H, Chen J, et al. The effect of pirfenidone on rat chronic prostatitis/chronic pelvic pain syndrome and its mechanisms. Prostate,2020,80(12):917-925.
[29] Xu X, Hou J, Lv J, et al. Overexpression of lncRNA GAS5 suppresses prostatic epithelial cell proliferation by regulating COX-2 in chronic non-bacterial prostatitis. Cell Cycle,2019,18(9):923-931.
[30] Meng L Q, Yang F Y, Wang M S, et al. Quercetin protects against chronic prostatitis in rat model through NF-kappaB and MAPK signaling pathways. Prostate,2018,78(11):790-800.
[31] Xu M, Jiang P, Sun H, et al. Dimethyl itaconate protects against lipopolysaccharide-induced endometritis by inhibition of TLR4/NF-kappaB and activation of Nrf2/HO-1 signaling pathway in mice. Iran J Basic Med Sci,2020,23(9):1239-1244.
[32] Zhang F X, Xu R S. Juglanin ameliorates LPS-induced neuroinflammation in animal models of Parkinson's disease and cell culture via inactivating TLR4/NF-kappaB pathway. Biomed Pharmacother,2018,97:1011-1019.
[33] Qin Y, Zheng B, Yang G S, et al. Salvia miltiorrhiza-Derived Sal-miR-58 Induces Autophagy and Attenuates Inflammation in Vascular Smooth Muscle Cells. Mol Ther Nucleic Acids,2020,21:492-511.
[34] Gong L, Pan Q, Yang N. Autophagy and Inflammation Regulation in Acute Kidney Injury. Front Physiol,2020,11:576463.
[35] Bostanciklioglu M. An update on the interactions between Alzheimer's disease, autophagy and inflammation. Gene,2019,705:157-166.
[36] Sakurai K, Dainichi T, Garcet S, et al. Cutaneous p38 mitogen-activated protein kinase activation triggers psoriatic dermatitis. J Allergy Clin Immunol,2019,144(4):1036-1049.
[37] Nikaido M, Otani T, Kitagawa N, et al. Anisomycin, a JNK and p38 activator, suppresses cell-cell junction formation in 2D cultures of K38 mouse keratinocyte cells and reduces claudin-7 expression, with an increase of paracellular permeability in 3D cultures. Histochem Cell Biol,2019,151(5):369-384.
[38] Li J, Sun Q, Zheng C, et al. Lipoxin A4-Mediated p38 MAPK Signaling Pathway Protects Mice Against Collagen-Induced Arthritis. Biochem Genet,2021,59(1):346-365.
[39] Zhou M, Xu W, Wang J, et al. Boosting mTOR-dependent autophagy via upstream TLR4-MyD88-MAPK signalling and downstream NF-kappaB pathway quenches intestinal inflammation and oxidative stress injury. EBioMedicine,2018,35:345-360.
[40] Ying Y, Sun C B, Zhang S Q, et al. Induction of autophagy via the TLR4/NF-kappaB signaling pathway by astragaloside contributes to the amelioration of inflammation in RAW264.7 cells. Biomed Pharmacother,2021,137:111271.
- 上一篇:秦国政教授应用“补通敛镇法”治疗免疫性不育经验浅析
- 下一篇:没有了



