张春和1, 叶妙勇2, 赵 凡3
(1云南省中医医院/云南中医药大学第一附属医院, 昆明 650021;2温州医科大学附属温岭医院, 温岭 317500;3南通大学附属医院, 南通 226001)
摘要:目的:探索黄芪多糖对低氧环境下SD大鼠膀胱平滑肌细胞缝隙连接蛋白43(Connexin43)表达的影响。 方法:酶消化法分离SD大鼠原代膀胱平滑肌细胞后进行培养、鉴定;构建体外膀胱平滑肌细胞缺氧模型,免疫印迹技术检测不同缺氧时间对膀胱平滑肌细胞中缺氧诱导因子-1α(HIF-1α)和Connexin43表达的影响;用低、高浓度黄芪多糖处理低氧环境下膀胱平滑肌细胞,免疫荧光和免疫印迹技术检测各组膀胱平滑肌细胞中HIF-1α和Connexin43表达强度。 结果:SD大鼠膀胱平滑肌细胞SM-α-actin呈阳性染色;与常氧组相比,低氧环境下培养6h或12h,膀胱平滑肌细胞中HIF-1α和Connexin43表达均升高(P均<0.05),24h时均显著升高(P均<0.01);低氧环境下培养膀胱平滑肌细胞24h的同时予黄芪多糖100g/ml或400g/ml进行处理,与低氧组相比,黄芪多糖干预组HIF-1α和Connexin43表达均受到抑制(P<0.05或P<0.01)。 结论:黄芪多糖对低氧环境下大鼠膀胱平滑肌细胞中HIF-1α和Connexin43蛋白表达升高可起到抑制作用,其中机理尚待进一步研究。
关键词:黄芪多糖;缺氧;膀胱平滑肌细胞;缝隙连接蛋白43;膀胱出口梗阻
基金资助:国家自然科学基金项目(No. 81774323, No.82004360, No. 81860853)
Study on the effects of hypoxic condition and Astragalus Polysaccharides (APS) on the expression of Connexin43 in the rat bladder smooth muscle cells and
ZHANG Chun-he1, Ye Miao-yong2, ZHAO Fan3
(1 Yunnan Provincial Hospital of Traditional Chinese Medicine/The First Affiliated Hospital of Yunnan University of Traditional Chinese Medicine, Kunming 650021, China; 2The Affiliated Wenling Hospital of Wenzhou Medical University, Wenling 317500, China; 3Affiliated Hospital of Nantong University, Nantong 226001, China)
Abstract: Objective: To investigate the effects of Astragalus Polysaccharides (APS) on the expression of Connexin43 (CX43) in the SD rat bladder smooth muscle cells (BSMCs) under hypoxic condition. Methods: Primary BSMCs enzymatically-digested from the bladder of SD rats were cultivated and identified. Influence of various-interval hypoxic exposure on the expressions of hypoxia-induced factor-1alpha (HIF-1α) and CX43 in BSMCs were detected by Western blot. Additionally, BSMCs under hypoxic condition were treated by low- or high- dosage of APS after which the expressions of HIF-1α and CX43 in BSMCs were detected by Western blot and Immunocytochemistry. Result: Rat BSMCs were positively stained by SM-α-actin. Compared with the normoxic group, the protein expressions of HIF-1α and CX43 in BSMCs were increased in 6 or 12 hours (h) (P<0.05) and significantly elevated in 24h (P<0.01). After BSMCs were treated by 100g/ml- or 400g/ml- APS along with hypoxic stimulation for 24h, the protein expressions of HIF-1α and CX43 in BSMCs which received APS treatment were inhibited when compared to the hypoxic group (P<0.05 or P<0.01). Conclusion: The uptrend of HIF-1α and CX43 protein expressions in BSMCs under hypoxia can be alleviated through APS treatment, but the mechanisms in which need a further study.
Key words:Astragalus Polysaccharides; Hypoxia; Bladder smooth muscle cells; Connexin43; Bladder outlet obstruction
Funding:National Natural Science Foundation of China (No. 81774323, No.82004360, No. 81860853)
良性前列腺增生(Benign prostatic hyperplasia,BPH)是导致膀胱出口部分梗阻(partial Bladder outlet obstruction,pBOO)和下尿路症状(Lower urinary tract symptoms,LUTs)的常见原因,尽管BPH造成LUTs的分子机理仍处于探索状态,但可以肯定的是,随着临床进展BPH患者膀胱(逼尿肌)的结构和功能都会出现病理性改变[1]。Levin RM等[2-4]在研究中已证实缺氧(Hypoxia)在BPH/pBOO介导的膀胱组织重塑及进展性功能损害过程中扮演了重要角色。细胞缝隙连接(Gap junction,GJ)的基本结构单位是连接子(Connexon),而连接子是由6个相同或相似的缝隙连接蛋白(Connexin,CX)呈环状排列而成,其中央形成的亲水性通道可允许膀胱细胞内外小分子通过。本课题组在前期研究中发现,与正常对照组相比,pBOO大鼠膀胱中CX43蛋白表达明显升高(图1,尚未公开发表),这与其他学者的报道是一致的[5]。而本文拟观察体外缺氧环境下大鼠原代膀胱平滑肌细胞(Bladder smooth muscle cells,BSMCs)中CX43的表达变化。
张锡纯先生认为“黄芪之性,善利小便”,笔者在临床中亦常配伍黄芪治疗BPH或膀胱功能障碍相关LUTs[6,7],并以黄芪作为君药组方构成院内制剂“前列通窍胶囊”[6, 8]。黄芪多糖(Astragalus Polysaccharides,APS)属于黄芪的主要有效成分,诸多研究已表明APS在抗动脉粥样硬化、抗氧化应激、抗感染及炎症反应等方面具有广阔的应用前景[9]。但APS在BPH/pBOO介导的膀胱损伤中所起到的防治作用机理尚不清楚,而本研究拟通过体外实验探讨APS对低氧环境下大鼠BSMCs中CX43表达的影响。
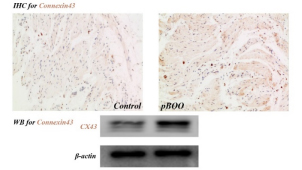
图1课题组前期研究表明pBOO大鼠膀胱组织中CX43含量显著升高
注:IHC:免疫组织化学,WB:免疫印迹,Control:正常对照
材料和方法
1 材料
1.1 细胞来源 经昆明医科大学实验动物中心购买SD大鼠(110±10g),许可证编号:SCXK(滇)2015-0004。颈椎脱臼处死大鼠后,立即经下腹腔解剖获得其膀胱组织,继而剥离浆膜及粘膜层,余下膀胱平滑肌层经酶消化法分离SD大鼠原代BSMCs(具体步骤见2.1)。
1.2 药品与试剂 黄芪多糖(货号:B20562)购自源叶生物;0.25%胰蛋白酶(货号:15050065)购自Thermo Fisher Scientific;I型胶原酶(货号:17018-029)、DMEM/F12培养基(货号:10565-042)、胎牛血清(货号:10100-147)均购自Gibco;RIPA裂解液(编号:P0013B)、PMSF(编号:ST506)、BCA蛋白浓度测定试剂盒(编号:P0012S)及DAPI(编号:C1002)均购自Beyotime Biotechnology;Triton X100(Sigma-Aldrich,货号:X100);4%组织细胞固定液(索莱宝,货号:P1110);SM-α-actin抗体(货号:19245S)和CX43抗体(货号:3512S)购自CST,HIF-1α抗体(Immunoway,货号:YT2133),β-actin抗体(BOSTER,货号:BA2305);羊抗兔IgG(LICOR,批号:C50317-02);SABC试剂盒(BOSTER,货号:SA1094)。
1.3 仪器 CO2培养箱(Thermo Fisher Scientific);小型台式离心机(Thermo Fisher Scientific);蛋白电泳仪及相关配件(Bio-Rad);Odyssey CLx双色红外激光成像系统(LICOR);荧光倒置显微镜(OLYMPUS)。
2 方法
2.1 原代SD大鼠BSMCs分离及培养 颈椎脱臼处死SD大鼠后,立即经腹腔分离获取其膀胱组织,置于预冷的PBS缓冲液漂洗后,转移至超净台下工作;将膀胱组织浸置于PBS缓冲液中,使用显微镊配合无菌棉签仔细剔除膀胱浆膜和黏膜层,分离出膀胱平滑肌层;将分离出的平滑肌层浸没在1ml 0.25%胰蛋白酶中,37℃摇床30分钟;吸出胰蛋白酶并打入0.125% I型胶原酶,用眼科剪将膀胱平滑肌层剪碎(1mm3),37℃下酶消化2.5 ~ 3小时后加入含10%FBS的DMEM/F12培养基终止消化;800rpm离心3分钟,小心倒去上清液,吸取2 ~ 3ml含10%FBS的DMEM/F12培养基轻柔地吹打混悬沉淀物,并转移至新的培养瓶中予以贴壁、培养。
2.2 原代SD大鼠BSMCs鉴定 SM-α-actin作为BSMCs分子标志物[10, 11]。将原代BSMCs接种至放有爬片的24孔板中,生长过夜。次日,4%多聚甲醛固定、0.5% Triton X100破膜、PBS溶液浸洗2遍,用5%BSA封闭。吸水纸吸掉封闭液,滴加足量的SM-α-actin一抗(1:500)并放入湿盒,4℃孵育过夜。用PBS溶液洗2 ~ 3遍,加入生物素标记羊抗兔IgG(1:1000),于37℃孵育30分钟,用PBS溶液洗后加入荧光显色剂(SABC),避光37℃孵育。1小时后再用PBS溶液浸洗,滴加DAPI(1:100,0.5mg/ml),避光室温下摇床孵育15分钟。PBS溶液浸洗后将盖玻片从孔板中取出,用抗荧光衰减封片剂封片于载玻片上。将载玻片放置于OLYMPUS荧光倒置显微镜下,用488mm波长激发,SM-α-actin标记的阳性细胞胞质呈绿色荧光。第2至4代SD大鼠原代BSMCs为该体外实验所需。
2.3 BSMCs缺氧模型构建 将培养基转移至新的细胞培养瓶,放入超声波仪器超声30min充分脱气,用脱气的培养基置换培养液。将BSMCs细胞培养瓶置入低氧环境中(参数依据前期研究[12]设定为:1%O2,5%CO2,94%N2),根据实验设计分别培养6h、12h、24h。
2.4 分组及APS干预 取对数生长期BSMCs,0.25% Trypsin消化以制成BSMCs细胞悬液,接种于4块六孔板中。次日,通过抽签将4块六孔板随机分为四个组:常氧组(Normoxia)、低氧组(Hypoxia)、低浓度(100g/ml)及高浓度(400g/ml)APS干预组。常氧组正常换液;其他各组均更换脱气的培养基,干预组同时加入低或高浓度的APS后于低氧环境下培养24h。
2.5 Western Blot技术检测BSMCs中HIF-1α和CX43信号强度 至实验终点,取出六孔板并倒去其中的BSMCs培养基,冰面上用预冷的PBS溶液迅速浸洗2遍。每孔加入200L含PMSF的细胞裂解液,1分钟后用细胞刮子将每孔BSMCs刮下并分别转移至相应1.5ml EP管,冰面上继续裂解30分钟,继而4℃下12000rpm离心15分钟,吸取细胞蛋白上清液并加入上样缓冲液,100℃金属浴15分钟使蛋白变性。经SDS聚丙烯酰胺凝胶电泳分离蛋白质,继而转膜2小时。脱脂奶粉溶液进行封闭后,4℃下相应一抗(HIF-1α:1:1000;CX43:1:1000;β-actin:1:4000)孵育过夜。次日常温下二抗孵育1.5小时,PBS溶液浸洗3遍后于Odyssey CLx双色红外激光成像系统下读取条带。利用ImageJ软件对条带进行半定量分析。
2.6 免疫细胞荧光技术检测BSMCs中HIF-1α和CX43荧光强度 在实验终点时取出六孔板,倒去培养液并在冰面上用预冷的PBS溶液迅速浸洗2遍后,4%多聚甲醛固定、0.5% Triton X100破膜。PBS溶液浸洗2遍,用5%BSA封闭。吸水纸吸掉封闭液,滴加足量的一抗(HIF-1α:1:100;CX43:1:100),4℃孵育过夜。余下步骤与2.2相仿,但无需封片,最终直接于荧光倒置显微镜下进行观察并留取图片。
3 统计学处理 实验研究过程中所收集的数据以±s表示,多个组别涉及多个样本均数之间的比较采用one-way ANOVA检验(结合Tukey’s multiple comparisons test)。上述统计均通过GraphPad Prism 7软件(San Diego,CA)实施,统计结果判定以P<0.05为差异具有统计学意义,P<0.01为差异具有显著统计学意义。
结果
1 原代SD大鼠BSMCs分离、培养及鉴定 经酶消化法分离获得的原代SD大鼠BSMCs刚接种于培养瓶时,呈球形且悬浮于培养液中。次日显微镜下再行观察可发现BSMCs大部分已呈贴壁生长状态。图2A为原代SD大鼠BSMCs接种96小时后显微镜下观察留取的图像。SM-α-actin为BSMCs分子标志物[10, 11],图2B中利用SM-α-actin抗体对BSMCs进行标记,呈绿色荧光;DAPI对BSMCs细胞核进行标记,呈蓝色荧光。融合(merge)后发现BSMCs阳性率高于95%。
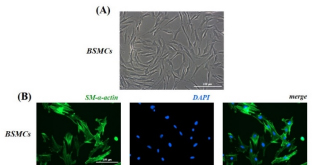
图2 原代SD大鼠BSMCs培养及鉴定
注:(A)普通光学显微镜视野下BSMCs(200×,标尺=100m);(B)荧光显微镜视野下BSMCs,
以SM-α-actin作为标记分子(200×,标尺=100m),merge:合并
2 Western Blot检测低氧环境下6h, 12h, 24h后BSMCs中HIF-1α和CX43表达变化 如图3A所示,与常氧组相比,BSMCs在低氧环境下(1%O2,5%CO2,94%N2)培育6h后,其HIF-1α和CX43蛋白信号强度即明显升高;利用ImageJ软件对条带进行半定量分析(图3B,n=4)后发现,与常氧组相比,低氧刺激6或12小时后,BSMCs中HIF-1α和CX43蛋白表达升高变化具有统计学意义(P均<0.05),而刺激24小时后,BSMCs中HIF-1α和CX43蛋白表达显著升高(P均<0.01)。在后续APS干预实验中,本研究将低氧刺激时间参数设置为24小时。
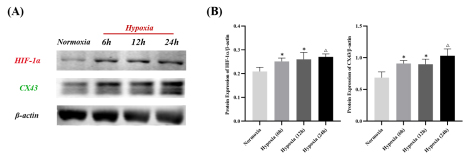
图3 低氧环境下时间梯度对BSMCs中HIF-1α和CX43表达的影响
注:(A)HIF-1α和CX43信号条带,以β-actin为内参;(B)Normoxia:常氧,Hypoxia:低氧;与Normoxia组相比,*P<0.05,△P<0.01. (n=4)
3 免疫荧光技术检测APS对低氧环境下BSMCs中HIF-1α表达的影响 常氧或低氧环境下同时培养BSMCs 24小时,药物干预组在低氧刺激的同时于培养基内加入APS(100g/ml或400g/ml)。如图4所示,低氧环境下24小时后,BSMCs中HIF-1α荧光表达强度明显升高,而100g/ml APS干预组BSMCs中HIF-1α荧光表达强度受到抑制,400g/ml APS干预组BSMCs中HIF-1α荧光表达强度显著被抑制。

图4 APS对低氧环境下BSMCs中HIF-1α表达的影响(细胞免疫荧光)
注:白色三角箭头指向HIF-1α红色荧光信号(200×,标尺=100m);Normoxia:常氧,Hypoxia:
低氧,APS:黄芪多糖,merge:合并
4 免疫荧光技术检测APS对低氧环境下BSMCs中CX43表达的影响 常氧或低氧环境下同时培养BSMCs 24小时,药物干预组在低氧刺激的同时于培养基内加入APS(100g/ml或400g/ml)。如图5所示,低氧环境下24小时后,BSMCs中CX43荧光表达强度明显升高,而100g/ml 或400g/ml APS干预组BSMCs中CX43荧光表达强度均显示较为明显的降低。
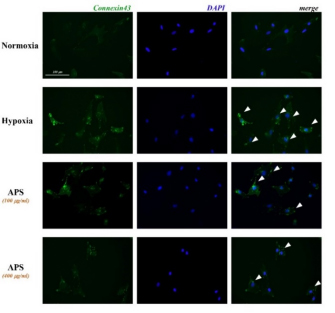
图5 APS对低氧环境下BSMCs中CX43表达的影响(细胞免疫荧光)
注:白色三角箭头指向CX43绿色荧光信号(200×,标尺=100m);Normoxia:常氧,Hypoxia:低氧,APS:黄芪多糖,merge:合并
5 Western Blot验证APS对低氧环境下BSMCs中HIF-1α和CX43表达的影响 为了佐证细胞免疫荧光实验结果,进一步利用Western Blot(免疫印迹技术)检测APS对低氧环境下BSMCs中HIF-1α和CX43蛋白表达的影响,结果显示,APS可一定程度上抑制低氧刺激24小时后BSMCs中HIF-1α和CX43蛋白表达增高(图6A);通过ImageJ软件进一步分析发现(图6B,n=4),100g/ml APS对BSMCs中HIF-1α和CX43蛋白表达增高的抑制作用均具有统计学意义(P均<0.05);400g/ml APS对BSMCs中HIF-1α蛋白表达增高的抑制作用具有显著统计学意义(P <0.01),对CX43蛋白表达增高的抑制作用具有统计学意义(P <0.05)。
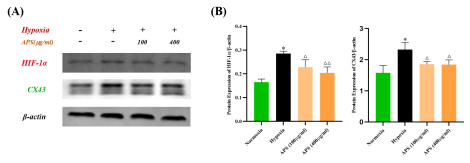
图6 APS对低氧环境下BSMCs中HIF-1α和CX43表达的影响(免疫印迹)
注:(A)HIF-1α和CX43信号条带,以β-actin为内参;(B)Normoxia:常氧,Hypoxia:低氧,APS:
黄芪多糖;与Normoxia组相比,*P<0.01;与Hypoxia组相比,△P<0.05,△△P<0.01.(n=4)
讨论
BPH是造成男性pBOO的常见病因,在疾病进展过程中,增生、肥大的前列腺持续性地对尿道造成机械压迫,继而损害上游膀胱结构和功能。其中,膀胱低氧在BPH/pBOO介导的膀胱病理生理中扮演了重要的角色[13, 14]。Levin RM等[13]在动物实验中发现,pBOO导致兔膀胱重量增加、收缩功能和代谢功能失常的同时,还造成膀胱逼尿肌和粘膜下区域中-重度缺氧。缺氧诱导因子-1α(Hypoxia inducible factor-1α,HIF-1α)是组织细胞受到缺氧刺激后的关键调控因子,pBOO小鼠膀胱缺氧的同时,HIF-1α信号亦得以激活[15]。Ekman M等[16]在研究中发现pBOO后膀胱逼尿肌组织中HIF-1α活化与葡萄糖转运蛋白和糖酵解酶的表达增加及线粒体蛋白质组重构紧密相关。在本研究中,SD大鼠原代BSMCs在低氧环境下培养后,其HIF-1α蛋白表达水平明显升高(以24h为著),表明体外BSMCs缺氧模型得以成功构建。
CX43介导的细胞间通讯在人和大鼠膀胱的同步收缩(syncytial contractions)中起到重要调节作用[5, 17],Christ GJ等[5]在研究中通过结扎SD大鼠部分尿道造成狭窄以模拟pBOO,结果显示pBOO诱导了膀胱过度活动(overactive bladder),并增强了大鼠膀胱组织中CX43蛋白和mRNA表达水平,这与笔者课题组前期研究中的发现是一致的(图1)。同样,GJ也是人BSMCs细胞间通讯的重要结构基础,并由此形成了局部的“功能合胞体(functional syncytia)”[18]。在正常人膀胱逼尿肌中,CX43呈低表达状态,而急迫性尿失禁患者膀胱逼尿肌中CX43表达明显升高[18]。同样,神经源性膀胱过度活动症患者逼尿肌中CX43蛋白和mRNA水平亦显著升高[19]。在既往研究中,笔者已发现缺氧可介导阴茎海绵体平滑肌细胞中CX43蛋白表达明显提高[12],而本研究证实了低氧环境可诱导SD大鼠原代BSMCs中CX43蛋白表达显著升高。
上述体外实验结果在一定程度上揭示了pBOO介导的膀胱缺氧和CX43表达升高之间的关系。继而,本研究进一步探讨了APS对缺氧状态下BSMCs中CX43高表达的干预作用。有文献报道APS对心肌微血管内皮细胞[20]、神经干细胞[21]等缺氧损伤具有改善作用。而本研究在一定程度上展示了APS具有抗BSMCs缺氧和调节缺氧后BSMCs间细胞通讯的潜力,但局限性在于无法直接说明APS是通过抑制HIF-1α信号而降低BSMCs中CX43表达。
综上所述,本研究通过在体外构建SD大鼠原代BSMCs缺氧模型,证实了低氧环境下BSMCs中HIF-1α和CX43蛋白表达均明显升高,而APS对低氧所致BSMCs中HIF-1α和CX43蛋白表达增高具有显著的抑制作用,但其中机理仍待进一步探索。
参 考 文 献
[1] Mirone V, Imbimbo C, Longo N, et al. The detrusor muscle: an innocent victim of bladder outlet Obstruction[J]. Eur Urol, 2007, 51(1): 57-66
[2] Levin RM, Longhurst PA, Monson FC, et al. Effect of bladder outlet obstruction on the morphology, physiology, and pharmacology of the
bladder[J]. Prostate Suppl, 1990, 3: 9-26
[3] Ghafar MA, Anastasiadis AG, Olsson LE, et al. Hypoxia and an angiogenic response in the partially obstructed rat bladder[J]. Lab Invest,
2002, 82(7): 903-909
[4] Ghafar MA, Shabsigh A, Chichester P, et al. Effects of chronic partial outlet obstruction on blood flow and oxygenation of the rat bladder[J].
J Urol, 2002, 167(3): 1508-1512
[5] Christ GJ, Day NS, Day M, et al. Increased connexin43-mediated intercellular communication in a rat model of bladder overactivity in
vivo[J]. Am J Physiol Regul Integr Comp Physiol, 2003, 284(5):1241-1248
[6] 张春和, 李焱风, 秦国政, 等. 前列通窍胶囊治疗肾虚瘀阻型前列腺增生症87例临床研究[J]. 中华中医药杂志, 2016, 31(10):
4299-4302
[7] 于波锋, 沈涛, 张春和. 黄芪治疗泌尿男科疾病的研究进展[J]. 云南中医学院学报, 2010, 33(3): 62-64
[8] Zhao F, Zhang CH, Yan JF, et al. Effects of Qianlie Tongqiao capsule on bladder weight and growth factors in bladder tissue of rats with
testosterone-induced benign prostatic hyperplasia[J]. Evid Based Complement Alternat Med, 2018, 2018: 5059267
[9] 杜雪洋, 梁建庆, 何建成, 等. 黄芪多糖的药理作用研究[J]. 西部中医药, 2019, 32 (6): 152-155
[10] 龚宇, 宋波, 金锡御, 等. 张力负荷状态对膀胱逼尿肌细胞表型及生物力学特性的影响[J]. 中华外科杂志, 2003, 41(12): 901-905
[11] Sawada N, Yao J, Hiramatsu N, et al. Involvement of hypoxia-triggered endoplasmic reticulum stress in outlet obstruction-induced
apoptosis in the urinary bladder[J]. Lab Invest, 2008, 88(5): 553-563
[12] Zhang X, Zhao F, Zhao JF, et al. PDGF-mediated PI3K/AKT/beta-catenin signaling regulates gap junctions in corpus cavernosum smooth
muscle cells[J]. Exp Cell Res, 2018, 362(2): 252-259
[13] Levin RM, O'Connor LJ, Leggett RE, et al. Focal hypoxia of the obstructed rabbit bladder wall correlates with intermediate
decompensation[J]. Neurourol Urodyn, 2003, 22(2): 156-163
[14] Woo LL, Tanaka ST, Anumanthan G, et al. Mesenchymal stem cell recruitment and improved bladder function after bladder outlet
obstruction: preliminary data[J]. J Urol, 2011, 185(3): 1132-1138
[15] Drzewiecki BA, Anumanthan G, Penn HA, et al. Modulation of the hypoxic response following partial bladder outlet obstruction[J]. J Urol,
2012, 188(4 Suppl): 1549-1554
[16] Ekman M, Uvelius B, Albinsson S, et al. HIF-mediated metabolic switching in bladder outlet obstruction mitigates the relaxing effect of
mitochondrial inhibition[J]. Lab Invest, 2014, 94(5): 557-568
[17] Christ GJ, Venkateswarlu K, Day NS, et al. Intercellular communication and bladder function[J]. Adv Exp Med Biol, 2003, 539(Pt A):
239-254
[18] Neuhaus J, Pfeiffer F, Wolburg H, et al. Alterations in connexin expression in the bladder of patients with urge symptoms[J]. BJU Int, 2005,
96(4): 670-676
[19] Haferkamp A, Mundhenk J, Bastian PJ, et al. Increased expression of connexin 43 in the overactive neurogenic detrusor[J]. Eur Urol, 2004,
46(6): 799-805
[20] Zhou Q, Meng G, Teng F, et al. Effects of astragalus polysaccharide on apoptosis of myocardial microvascular endothelial cells in rats
undergoing hypoxia/reoxygenation by mediation of the PI3K/Akt/eNOS signaling pathway[J]. J Cell Biochem, 2018, 119(1): 806-816
[21] Zheng Z, Zhao B. Astragalus polysaccharide protects hypoxia-induced injury by up-regulation of miR-138 in rat neural stem cells[J].
Biomed Pharmacother, 2018, 102: 295-301
- 上一篇:慢性萎缩性胃炎不同病理类型的中医体质分布规律
- 下一篇:中医药治疗风湿病临证体会



